阿拉伯糖基转移酶EmbA,EmbB和EmbC参与结核分枝杆菌细胞壁合成,是抗结核药物乙胺丁醇的靶点。本研究使用冷冻电镜和X射线晶体显微技术,成功解析出EmbA-EmbB和EmbC-EmbC复合物与自身糖基供体、受体底物以及乙胺丁醇相结合时的结构。这些结构阐明了供体和受体底物在活性位点的结合机制,以及乙胺丁醇的抑制作用机理,首次阐明这个使用了近60年,治愈无数结核病感染者的一线药物的抑制作用机理,并首次揭示了结核分枝杆菌临床耐乙胺丁醇的分子机制。
研究结果显示,每个Emb蛋白单体均为含有氨基端15次跨膜螺旋的跨膜区和羧基端可溶区结构域的折叠形式,并且以EmbA-EmbB或EmbC-EmbC组成异源或同源二聚体,并首次报道了每个Emb蛋白均在胞内结合一个酰基载脂蛋白AcpM,最终组成EmbA-EmbB-AcpM2/EmbC2-AcpM2蛋白复合物。据悉,这是世界上第一个解析的源于结核分枝杆菌的膜蛋白三维结构,该研究共解析并向蛋白质数据库(protein data bank, PDB)投递5个蛋白质结构坐标,为全世界范围研发设计新型抗结核抑制剂提供可靠的数据支撑。
该研究中冷冻电镜数据在上海科技大学生物电镜平台收集。
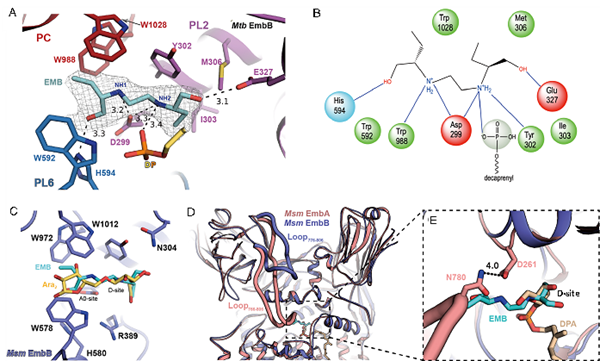
(A,B)乙胺丁醇结合方式;(C,D,E)结构叠合发现乙胺丁醇占据底物阿拉伯糖的结合位点(D-site和A0-site)。
文章链接:

